
貝克曼庫(kù)爾特商貿(mào)(中國(guó))有限公司
 白金會(huì)員
白金會(huì)員 已認(rèn)證
已認(rèn)證

貝克曼庫(kù)爾特商貿(mào)(中國(guó))有限公司
 白金會(huì)員
白金會(huì)員 已認(rèn)證
已認(rèn)證


宿主細(xì)胞蛋白(HCP)的法規(guī)要求對(duì)于確保生物制藥產(chǎn)品的質(zhì)量和安全性至關(guān)重要。經(jīng)測(cè)試,殘留的HCP可能引起不良反應(yīng),如免疫反應(yīng),也需要關(guān)注到的是殘留的HCP可能影響藥物的活性,導(dǎo)致藥物效果降低,影響治療效果。這些負(fù)面影響會(huì)直接導(dǎo)致藥物的安全性問(wèn)題,甚至可能對(duì)患者的健康產(chǎn)生威脅。例如,某些研究表明,ECP(大腸桿菌多肽)的存在與抗ECP抗體和抗rhGH抗體的產(chǎn)生相關(guān),可能導(dǎo)致免疫反應(yīng)等。 HCP殘留含量也被認(rèn)為是生物制品的關(guān)鍵質(zhì)量屬性(CQA),是工藝穩(wěn)健性監(jiān)測(cè)的重要評(píng)價(jià)指標(biāo),也是產(chǎn)品的重要質(zhì)控指標(biāo)。對(duì)于HCP的法規(guī)要求是多層次、多方面的,旨在確保生物制藥產(chǎn)品的安全性、有效性和質(zhì)量。許多國(guó)家和地區(qū)的藥品監(jiān)管機(jī)構(gòu)都要求生物藥物在上市前必須進(jìn)行HCP殘留的檢測(cè)。這是為了確保藥物的安全性和有效性,滿足法規(guī)要求。制藥企業(yè)應(yīng)嚴(yán)格遵守相關(guān)法規(guī)要求,采用合適的檢測(cè)方法和控制策略,確保HCP殘留量在可接受范圍內(nèi)。 1.國(guó)際法規(guī)要求: ICH Q6B指南:國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)(ICH)的Q6B指南指出,需要根據(jù)ICH準(zhǔn)則采用敏感且經(jīng)過(guò)驗(yàn)證的有效方法來(lái)監(jiān)控殘留的HCP,其殘留量通常要求小于100ppm。 美國(guó)藥典(USP):USP<1132>章節(jié)規(guī)定,用一種靈敏度較高的方法檢測(cè)藥品中的HCP,其含量應(yīng)該低于檢測(cè)限(通常小于100ppm,即1mg總蛋白中HCP含量應(yīng)小于100ng,也即<0.01%)。 歐洲藥典(EP):EP 2.6.34中規(guī)定,在生物制品中,HCP的含量應(yīng)當(dāng)小于0.1%。 2.國(guó)家/地區(qū)藥典要求: 中國(guó)藥典(2020版): 針對(duì)CHO細(xì)胞,HCP殘留需要<0.05%(相當(dāng)于小于500ppm)。 針對(duì)E.coli,HCP殘留需要<0.01%。 其他國(guó)家:不同國(guó)家和地區(qū)的藥典可能有各自的HCP殘留標(biāo)準(zhǔn),但都旨在確保生物制藥產(chǎn)品的安全性和質(zhì)量。
而在實(shí)驗(yàn)室中常規(guī)的宿主細(xì)胞蛋白殘留 檢測(cè)方法如下: 1 酶聯(lián)免疫吸附試驗(yàn)(ELISA) 原理:利用特異性抗體與宿主蛋白結(jié)合,通過(guò)測(cè)定抗原-抗體反應(yīng)來(lái)定量宿主蛋白的殘留水平。 優(yōu)點(diǎn):靈敏度高,可用于定量檢測(cè)。 缺點(diǎn):需要有針對(duì)特定HCPs的抗體,可能產(chǎn)生假陽(yáng)性或假陰性的結(jié)果。 自動(dòng)化:可以使用自動(dòng)化工作站,如Biomek i7,來(lái)提高準(zhǔn)確性和檢測(cè)通量。 2 二維電泳-質(zhì)譜聯(lián)用法(2D-PAGE-MS) 原理:基于蛋白質(zhì)分子量和等電點(diǎn)差異進(jìn)行分離,通過(guò)質(zhì)譜分析進(jìn)行蛋白質(zhì)鑒定。 優(yōu)點(diǎn):可檢測(cè)更廣泛的HCPs,提供全面的蛋白質(zhì)譜。 缺點(diǎn):操作復(fù)雜,需要較高的技術(shù)水平。 3 多肽映射法 原理:通過(guò)蛋白質(zhì)酶切、高效液相色譜、質(zhì)譜等步驟,獲得蛋白質(zhì)的多肽圖譜,進(jìn)行結(jié)構(gòu)鑒定和定量分析。 優(yōu)點(diǎn):準(zhǔn)確性高,適用于復(fù)雜樣品的分析。 缺點(diǎn):操作步驟復(fù)雜,需要較高的技術(shù)水平和專業(yè)設(shè)備。 4 電泳法 包括CIE(毛細(xì)管電泳)、SDS-PAGE(十二烷基硫酸鈉聚丙烯酰胺凝膠電泳)等。 優(yōu)點(diǎn):反應(yīng)時(shí)間短、靈敏性高(如CIE)。SDS-PAGE簡(jiǎn)便、快速、重復(fù)性好。 缺點(diǎn):分辨率低(如CIE、SDS-PAGE)、不能精確定量(如SDS-PAGE)。 5 質(zhì)譜法 原理:直接檢測(cè)蛋白質(zhì)的質(zhì)量和結(jié)構(gòu),通過(guò)比對(duì)目標(biāo)蛋白和宿主蛋白的質(zhì)譜圖譜進(jìn)行定量分析。 優(yōu)點(diǎn):高靈敏度、高分辨率,可同時(shí)檢測(cè)多個(gè)宿主蛋白。 缺點(diǎn):需要復(fù)雜的樣品準(zhǔn)備和數(shù)據(jù)分析過(guò)程。 6 生物活性測(cè)定法 原理:通過(guò)測(cè)定宿主蛋白對(duì)生物活性的影響來(lái)驗(yàn)證殘留。 優(yōu)點(diǎn):提供宿主蛋白殘留對(duì)藥物活性的直接影響信息。 缺點(diǎn):可能在特定情況下不夠敏感或特異性。
在選擇宿主細(xì)胞蛋白殘留檢測(cè)方法時(shí),需要考慮多個(gè)因素,包括所需的靈敏度和準(zhǔn)確性、樣品的復(fù)雜性、以及可用的設(shè)備和技術(shù)水平。通常,結(jié)合多種方法可以確保最終藥物產(chǎn)品的質(zhì)量和安全性。
今天小貝帶來(lái)了 基于ELISA的自動(dòng)化檢測(cè)宿主細(xì)胞蛋白殘留標(biāo)準(zhǔn)化流程——標(biāo)準(zhǔn)化無(wú)人值守

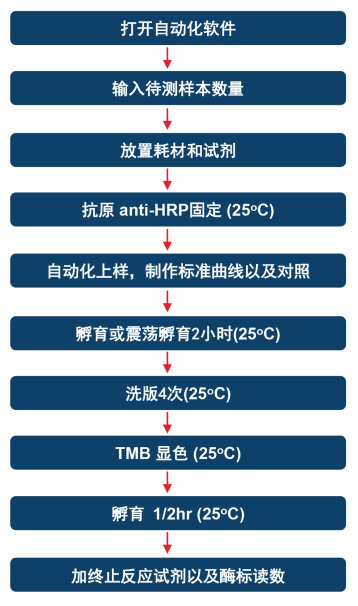
圖1. 自動(dòng)化HCP檢測(cè)流程展示
更高線性的標(biāo)曲——高精度移液體現(xiàn)
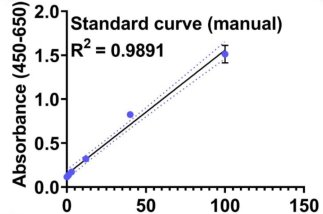
自動(dòng)化 人工 圖2. 使用CygnusTM CHO HCP ELISA 試劑盒對(duì)于自動(dòng)化再現(xiàn)性的驗(yàn)證。手工和自動(dòng)化的標(biāo)曲比較結(jié)果如圖二A和B所示,對(duì)比R2的數(shù)值自動(dòng)化動(dòng)化結(jié)果更好。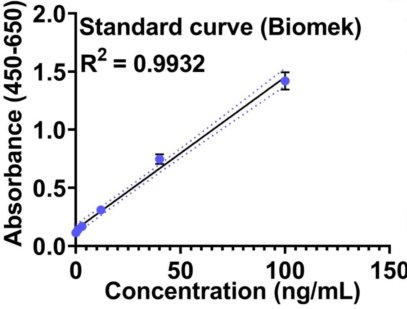
穩(wěn)定的結(jié)果保證——高重現(xiàn)性
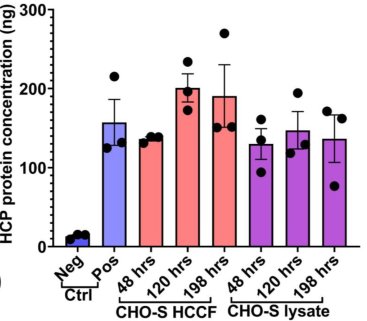
使用Biomek i7自動(dòng)化工作站完成對(duì)不同時(shí)間宿主細(xì)胞培養(yǎng)基和細(xì)胞裂解液的蛋白定量檢測(cè)。
貝克曼庫(kù)爾特生命科學(xué)提供專業(yè)的軟件硬件支持,以及客戶應(yīng)用開(kāi)發(fā)來(lái)滿足大家對(duì)于生命科學(xué)自動(dòng)化的需求。 關(guān)于貝克曼庫(kù)爾特生命科學(xué)自動(dòng)化整合部門(mén)介紹: 貝克曼自動(dòng)化整合部門(mén)位于美國(guó)Indianapolis,該部門(mén)位于Beckman質(zhì)量管理系統(tǒng)下,并經(jīng)過(guò)ISO9001認(rèn)證,部門(mén)配備整合實(shí)驗(yàn)室,完成整合設(shè)備的研發(fā)。 整合部門(mén)人員包含機(jī)械、電子、軟件、系統(tǒng)工程師,和工程師支持、項(xiàng)目管理人員。 人員配備齊全,售前售后響應(yīng)快速。 如有特殊功能開(kāi)發(fā),Beckman團(tuán)隊(duì)可協(xié)助客戶在國(guó)內(nèi)進(jìn)行軟硬件開(kāi)發(fā)和測(cè)試。
*以上內(nèi)容涉及設(shè)備僅適用于科研和工業(yè),不用于臨床診斷。
相關(guān)產(chǎn)品
更多
相關(guān)文章
更多
技術(shù)文章
2024-11-21技術(shù)文章
2024-11-15技術(shù)文章
2024-11-15技術(shù)文章
2024-11-01