參考價格
面議型號
(RTCA)DP 實時細胞分析儀品牌
杰靈儀器產地
天津樣本
暫無誤差率:
-分辨率:
-重現性:
-儀器原理:
其他分散方式:
-測量時間:
-測量范圍:
-看了(RTCA)DP 實時細胞分析儀的用戶又看了
 留言詢價
留言詢價
虛擬號將在 180 秒后失效
使用微信掃碼撥號
xCELLigence?實時細胞分析(RTCA)DP儀器使用無創電阻抗監測,以無標簽的實時方式量化細胞增殖,形態變化和附著質量。 DP模型與其他xCELLigence儀器的區別是其使用電子集成的Boyden室(CIM-Plate?16)進一步對細胞侵襲和遷移(CIM)進行動力學測量的能力。 DP儀器的三個支架允許三個獨立的電子16孔板并聯或彼此獨立地進行控制和監控,從而實現多個用戶的**生產力。將儀器置于標準的CO2細胞培養箱中,并通過連接到孵化器外部的控制單元(筆記本電腦)的電纜進行供電和控制。用戶友好的RTCA軟件允許與所有三個支架實時接口,并包括實時數據顯示和分析功能。
細胞阻抗說明
在細胞生物化學測定和全身生物體內實驗之間定位,基于細胞的測定是基礎和應用生物學研究不可缺少的工具。然而,許多基于細胞的測定法的用途通過以下方式減少了:(1)需要使用標記;(2)與連續監測不相容(即僅產生終點數據);(3)與正交試驗不相容;和( 4)無法提供客觀/定量的讀數。然而,這些缺點都是通過非侵入性的,無標記的和實時的細胞阻抗測定來克服的。 細胞阻抗測定的功能單元是融合到微量滴定板孔的底部表面的一組金微電極(圖1)。當浸沒在導電溶液(如緩沖液或標準組織培養基)中時,在這些電極上施加電位會使電子離開負極,通過本體溶液,然后沉積到正極端以完成電路。因為這種現象取決于電極與本體溶液相互作用,所以在電極 - 溶液界面處的粘附細胞的存在阻礙了電子流動。該阻抗的大小取決于細胞的數量,細胞的大小和形狀以及細胞 - 基底附著質量。重要的是,金微電極表面和施加的電位(22 mV)都不影響細胞的健康或行為。

圖1.細胞阻抗裝置概述在單元格添加之前和之后顯示單個孔的側視圖。電極和電池都不被拉伸(為了清晰起見,它們被放大)。在不存在電池的情況下,電流自由流動通過培養基,完成電極之間的電路。由于細胞在電極上粘附并增殖,電流流動受阻,提供了細胞數量,細胞大小/形態以及細胞 - 基質附著質量的非常靈敏的讀數。
阻抗電極
ACEA E-Plate板中每孔中的金微電極生物傳感器覆蓋70-80%的表面積(取決于是否存在視野區域)。而不是圖1所示的簡化的電極對,E-Plate板的每個孔中的電極被連接成形成交錯陣列的“線”(圖2)。這種布置可以同時監測細胞群體,從而提供精確的靈敏度:附著于板的細胞數,細胞的大小/形態以及細胞 - 基質附著質量。

圖2. ACEA E-Plate板上的阻抗電極。 (A)E-Plate板的每個孔中使用的叉指電極的簡化示意圖。電極沒有按比例繪制(僅顯示一些電極,為了清晰起見,它們已被放大)。雖然細胞也可以在金電極表面上可視化,但在中間的無電極區域有助于顯微成像(亮場,熒光等)。 (B)16孔E-Plate板中單孔的照片。 (C)放大陰影電極和未染色人體細胞的明場圖像。 (D)復合顯微鏡中觀察到的金電極和結晶紫染色的人細胞。
用于實時細胞遷移/浸潤的設備
盡管它可以與其他xCELLigence儀器一樣運行測試,但是xCELLigence RTCA DP模型具有使用ACEA CIM-Plate進行實時細胞侵襲/遷移測定的附加功能,該實驗基本上是電子集成的Boyden室。如圖3A所示,將細胞直接置于微孔膜的頂部(遷移測定)上或在預先沉積在膜上的基底膜基質和/或細胞單層的頂部(入侵測定)上放置在上室中。移動到下腔室的化學引誘劑,細胞通過微孔膜,然后沉積到金阻抗電極上(在本技術概述的前兩節中描述)。這提供了細胞遷移/侵襲的非常靈敏和可重復的連續動力學記錄(圖3B)。使用顯微成像定量遷移細胞的平行測定證明了CIM-Plate的阻抗信號與已經遷移的細胞數量之間的**相關性。

圖3.細胞侵襲/遷移的定量實時分析。 (A)CIM板細節。上圖顯示了CIM-Plate八孔的剖視圖。下圖中的放大圖示出了單個孔的上部和下部室。上室的底表面由細胞可以遷移穿過的微孔膜組成。該膜下側的金電極檢測粘附細胞的存在。對于簡單的遷移測定(本文未示出),被監測的細胞將直接電鍍在膜上。對于入侵測定(在此顯示),將細胞鋪在基底膜基質,細胞單層或其某些組合的頂部。 (B)在存在或不存在化學引誘物的情況下實時分析鼠巨噬細胞遷移。在沒有細胞(陰性對照;藍線)的情況下,阻抗信號在測定的75分鐘內不變。雖然一些細胞在不存在化學引誘物(綠線)的情況下遷移通過多孔膜,但當化學引誘物存在于CIM板的下室(紅線)時,巨噬細胞遷移顯著刺激。圖“B”改編自PLoS One。 2013年3月8(3):e58744。
實時阻力跟蹤說明
使用稱為細胞指數(CI)的無單位參數報告了由貼壁細胞引起的電子流的阻抗,其中CI=(時間點n阻抗-不存在細胞時阻抗)/標稱阻抗值。圖3提供了在建立和運行凋亡實驗過程中實時阻抗曲線的通用示例。在細胞添加到孔中的頭幾個小時之后,阻抗快速增加。這是由于懸浮液中的細胞脫落,沉積在電極上并形成局部粘連。如果添加的細胞的初始數量低,并且在井底上存在空的空間,則細胞將增殖,導致CI逐漸但穩定增加。當細胞達到匯合CI值時,反映了大容量介質可接近的電極表面積不再改變的事實。此時加入細胞凋亡誘導劑導致CI降低至零。這是細胞四舍五入,然后從井底分離的結果。雖然這個通用實例涉及細胞融合時的藥物添加,基于阻抗的測定是非常靈活的,并且還可以評估初始細胞粘附到電極的速率和程度,或細胞增殖的速率和程度。

圖4.用于建立和運行凋亡測定的通用實時阻抗曲線。 在文中解釋了阻抗曲線的每個階段及其產生的蜂窩行為。
超出上述通用示例,圖5顯示了使用ACEA的xCELLigence 實時無標記儀器中的E-Plate采集的實際實時阻抗數據。 圖5A顯示了將A549細胞加入到E-Plate板中的前兩小時的阻抗曲線,其中孔預先用不同濃度的膠原IV包被。 雖然圖5B顯示了在將HeLa細胞暴露于GPCR激動劑多巴胺的前幾分鐘內發生的細胞指數的變化,圖5C評估在20小時內NK細胞介導的癌細胞的細胞溶解。 圖5D突出顯示根據藥物作用機制可能在細胞指數中發生的變化。
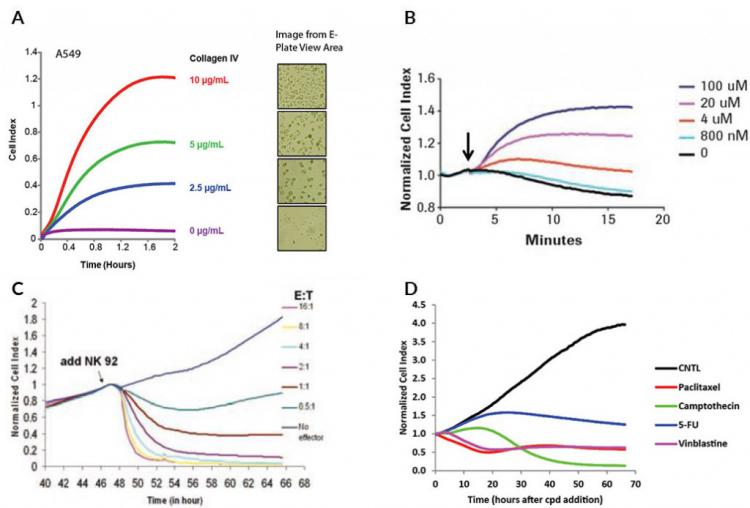
圖5.使用E-Plate板和xCELLigence RTCA儀器獲得的實時阻抗曲線示例。 (A)實時監測已經預先涂覆不同濃度膠原IV的E-Plate孔的A549細胞粘附。請注意阻抗值(細胞指數)與顯微鏡中可見的貼壁細胞數之間的相關性。 (B)暴露于不同濃度GPCR激動劑多巴胺的HeLa細胞的實時阻抗曲線。黑色箭頭表示多巴胺加入的時間。 (C)用于NK細胞介導的MCF7乳腺癌細胞溶解的實時阻抗曲線。 (D)暴露于藥物的A549細胞的實時阻抗曲線顯示各種作用機制。
與細胞相關的阻抗
RTCA提供細胞數量,增殖率,細胞大小/形狀和細胞 - 底物附著質量的定量讀數。由于這些物理性質是數千種不同基因/蛋白質的產物,因此RTCA可以為細胞健康和行為提供非常廣泛的視野。在xCELLigence儀器上已經成功地分析了從內皮屏障功能和趨化性到絲狀偽足動力學和免疫細胞介導的細胞溶解的一切。盡管它們的廣泛性,xCELLigence測定仍然能夠詢問非常具體的生化和細胞現象。適當使用對照和/或正交技術使得可以將阻抗跡線的特征與特定的細胞/分子現象相關聯。
暫無數據!
 (RTCA)DP 實時細胞分析儀的工作原理介紹?
(RTCA)DP 實時細胞分析儀的工作原理介紹? (RTCA)DP 實時細胞分析儀的使用方法?
(RTCA)DP 實時細胞分析儀的使用方法? (RTCA)DP 實時細胞分析儀多少錢一臺?
(RTCA)DP 實時細胞分析儀多少錢一臺? (RTCA)DP 實時細胞分析儀使用的注意事項
(RTCA)DP 實時細胞分析儀使用的注意事項 (RTCA)DP 實時細胞分析儀的說明書有嗎?
(RTCA)DP 實時細胞分析儀的說明書有嗎? (RTCA)DP 實時細胞分析儀的操作規程有嗎?
(RTCA)DP 實時細胞分析儀的操作規程有嗎? (RTCA)DP 實時細胞分析儀的報價含票含運費嗎?
(RTCA)DP 實時細胞分析儀的報價含票含運費嗎? (RTCA)DP 實時細胞分析儀有現貨嗎?
(RTCA)DP 實時細胞分析儀有現貨嗎? (RTCA)DP 實時細胞分析儀包安裝嗎?
(RTCA)DP 實時細胞分析儀包安裝嗎? 手機版:
手機版: