
步琦實驗室設備貿易(上海)有限公司
 白金會員
白金會員 已認證
已認證

步琦實驗室設備貿易(上海)有限公司
 白金會員
白金會員 已認證
已認證
RNA 的干燥和遞送平臺
在過去幾年中,脂質納米顆粒(LNPs)已被發現是 RNA 傳遞的有效載體,有多個傳染病和癌癥治療的臨床試驗可證實。以 mRNA 為載體的疫苗對于治療嚴重疾病如嚴重急性呼吸綜合征冠狀病毒2型(SARS-CoV-2)的成功一定程度上可歸功于開發了包含 mRNA 的 LNPs 以實現有效的細胞內傳遞。本文探討了噴霧干燥工藝作為凍干以外的另一種脫水過程,可以提高 LNPs 的穩定性并提供可替代的給藥途徑。
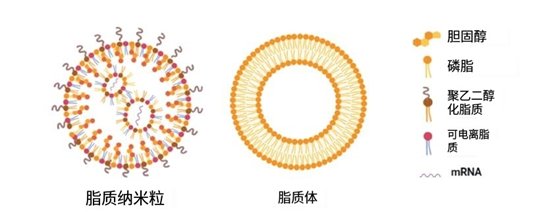
▲圖1.聚乙二醇化脂質納米顆粒和脂質體的示意圖
RNA 疫苗的挑戰
疫苗液體配方的穩定性問題可能成為其工業化和分銷的障礙。高溫可能會影響疫苗的穩定性因此,通常需要冷鏈系統來保持疫苗的活性。mRNA 儲存過程中的化學不穩定性包括 N-糖苷鍵的水解、磷酸二酯鍵的水解、胞嘧啶衍生物的脫氨和核堿基或糖部分的氧化。然而,當疫苗轉化為干粉時,可獲得更強的熱穩定性和更長的保質期。
利用凍干技術制備 RNA 疫苗
凍干或冷凍干燥是干燥疫苗最常用的方法,處理過程由三部分組成:
組成部分
1.形成冰晶的冷凍過程
2.通過低溫升華除去冷凍水的初級干燥過程
3.通過解析干燥除去殘留水的次級干燥過程
較高的冷凍溫度、較慢的冷凍速率和較長的次級干燥時間都有利于干燥過程的穩定性。然而,在這個復雜的過程中會產生應力源,如冷凍和干燥應力。冰對顆粒產生的機械應力和 PEG 層的結晶會導致顆粒融合,這些都是在冷凍過程中可能發生的情況。冷凍保護劑或凍干保護劑等輔料是在凍干前添加到顆粒懸浮液中的穩定劑,最常用的是糖類(如海藻糖)或糖醇(如甘露醇)。
關于使用冷凍保護劑或凍干保護劑來穩定納米顆粒的幾個理論中,非晶玻璃理論最為廣泛接受,具體是指在冷凍過程中,冷凍保護劑凝固成顆粒周圍的無定形玻璃,保護它們免受融合。2007 年,Jones 等人報道,在冷凍干燥之前,在自擴增 RNA 中加入海藻糖,可以在冷藏條件下保持至少 10 個月的穩定性,并且在轉染后,觀察到了高水平表達[1]。幾年后,mRNA 疫苗對傳染病(流感)的有效性首次在動物模型中得到證實。凍干的 mRNA 流感疫苗在小鼠免疫前 37°C 可以穩定保存 3 周[2]。該研究小組在后來的一篇論文中報道,在 70°C 條件下暴露于抗狂犬病感染的非復制 mRNA 疫苗并不影響其保護能力[3]。
CureVac 也報道,另一種同樣抗狂犬病的 mRNA 疫苗經海藻糖凍干,在 5-25°C 下可以穩定保存3年,在 40°C 可穩定保存 6 個月[4]。最近,發表了一項關于 mRNA 負載 LNPs 的研究,Zhao 等人比較了兩種不同的長期儲存mRNA納米顆粒的方法。他們觀察到,盡管使用 20% (w/v)的蔗糖或海藻糖穩定了納米顆粒的大小和 mRNA 的體外遞送效率,但相同的顆粒在體內遞送效率不高。原因可能是在凍干和重構過程中納米顆粒結構發生了變化。在添加 5% (w/v)蔗糖或海藻糖的液氮中冷凍裝載 mRNA 的 LNPs 可能是長期儲存的替代方案[5]。
利用噴霧干燥技術制備 RNA 疫苗
噴霧干燥提供了一種替代方法來生產干燥疫苗,這種疫苗能耗更低,操作成本更低,并且避免了細胞冷凍和高真空。噴霧干燥是一個連續的干燥過程,它包括四個主要階段:
主要階段
1.液體進料的霧化
2.熱干燥氣體與霧化噴霧的接觸
3.干燥顆粒的形成
4.顆粒的氣固分離
一個重要的觀點是,噴霧干燥疫苗可用于非傳統給藥途徑,如口服、肺部或鼻內途徑。盡管有這些優點,但在噴霧干燥過程中,由于高溫和剪切力,系統可能不穩定。熱應力和剪應力都增加了動能,加劇了顆粒的碰撞。在此過程中脂質部分熔化也會導致顆粒聚集,因此建議使用熔點高于 70℃ 的脂質。粒徑分布、聚合物分散性指數(Pdi)接近1和高變異系數的差異是顆粒聚集的信號。可以通過添加合適的穩定劑或使用酒精來代替水溶液分散介質可以降低熱應力。另一方面,可以通過使用低脂質含量或添加穩定劑來最小化剪切應力。糖類是最常用的穩定劑,但也常添加其他輔料,如二價離子、蛋白質、表面活性劑和聚合物。
1998 年,醫藥領域首次對脂質納米顆粒進行噴霧干燥研究,其作者展示了將固體 LNP 懸浮液成功轉化為粉末形式,使用非常低的脂質濃度(1%)和高海藻糖濃度(25%)作為噴霧干燥基質[6]。在噴霧干燥之前,在脂質納米顆粒上添加生物聚合物,如酪蛋白、果膠或木瓜蛋白酶,可以有效防止 LNP 聚集。Gaspar 等人用木瓜蛋白酶層覆蓋固體 LNP,然后用海藻糖或甘露醇噴霧干燥[7]。也有報道將裝載姜黃素的固體 LNP 用一層果膠進行噴霧干燥,然后進行化學交聯。交聯確實可以改善固體 LNP 的物理化學性質[8]。作者也使用了不同的天然多糖,如果膠、卡拉膠、羧甲基纖維素、阿拉伯膠和海藻酸鹽作為壁材,但都發生了顆粒聚集。而用果膠或卡拉膠噴霧干燥含有 20-30% 油酸的 LNP 可獲得穩定的粉末顆粒[9]。文獻中報道了聚合物雜交 LNP,例如用透明質酸與聚丙烯酸交聯制備了阿昔洛韋載藥聚合物混合脂質納米顆粒。與常規制劑相比,阿昔洛韋的溶解度可提高 30%,提高了其作為口服給藥系統的生物利用度[10]。最近,Dormenval 等人用甘露醇作為穩定賦形劑制備了噴霧干燥負載 siRNA 的聚合物雜化 LNP。該小組還打算使用微流體技術進一步擴大工藝規模[11]。
目前為止,還沒有商業化的噴霧干燥疫苗。然而,已有藥企開展了一些研究,特別是以流感和結核病為重點的研究。關于噴霧干燥的 mRNA 治療目前報道研究較少,與噴霧干燥的 mRNA 載藥 LNPs 也較少。Patel等人首次報道可吸入的 mRNA 遞送,在他們的研究中, mRNA 通過霧化方式由超支化聚氨基酯(hPBAEs)傳遞給小鼠,在小鼠肺上皮中觀察到高水平的基因表達[12]。最近香港大學的研究人員首次表明,可以使用噴霧干燥和噴霧冷凍干燥制備可吸入的 mRNA 干粉。這種聚乙二醇化的 KL4/mRNA 復合物在健康小鼠的肺中產生了良好的基因表達,并且沒有引起明顯的毒性和炎癥反應[13]。
結論
基于臨床前和臨床研究,使用 LNPs 作為納米載體的 mRNA 疫苗已顯示出治療多種化學疾病包括傳染病和癌癥的巨大潛力。LNPs 與其他載體相比具有多種優勢:mRNA 保護、更高載荷的遞送、靶配體的結合以及與佐劑的共傳遞。通常情況下,mRNA 疫苗制劑以液態開發并冷凍儲存。為了優化其分布和儲存能力,人們對開發耐熱的 mRNA 配方產生了興趣。噴霧干燥是傳統凍干技術的一個不錯替代選擇,因為噴霧干燥在顆粒工程和非傳統疫苗給藥途徑有天然優勢。
關注瑞士步琦,無論是凍干技術還是噴霧干燥,都能為您的 RNA 干粉制備提供完美解決方案。

▲L-300 凍干機

▲S-300 噴霧干燥儀
最新動態
更多





虛擬號將在 秒后失效
使用微信掃碼撥號