
大昌華嘉科學儀器部
 白金會員
白金會員 已認證
已認證

大昌華嘉科學儀器部
 白金會員
白金會員 已認證
已認證
蛋白質的穩定性指的是蛋白質抵抗各種因素的影響,保持其生物活力的能力。蛋白質在細胞和生物體的生命活動過程中,起著十分重要的作用。從生物的構成到生物的新陳代謝、遺傳都和蛋白質的結構和功能密切相關。生物的結構和性狀都與蛋白質有關。因此,合適的表征手段對研究蛋白質變性至關重要。
一、蛋白質失活的原因和機理:
1蛋白水解酶和自溶作用
1.1酶在使用和貯存過程中的失活常是由于微生物和外源蛋白水解酶作用的結果。蛋白水解酶可催化肽鍵水解。
1.2 當蛋白質底物也是一種蛋白水解酶時,就會發生自我降解現象,叫做自溶。
2 聚合作用
蛋白質發生可逆性伸展——>伸展的蛋白質分子彼此締合——>可能發生蛋白質分子間二硫鍵的形成從而使蛋白質沉淀析出。蛋白質的聚合作用和沉淀的區別:蛋白質的聚合作用可能是可逆的,并不一定是不可逆的。沉淀作用意味著蛋白質并未發生顯著的構象變化即從溶液中析出。因此沉淀很容易再溶于水溶液宏,并恢復其全部天然特性。
3 極端pH
極端pH下引起蛋白質變性的重要因素是:一旦遠離了蛋白質的等電點,那么蛋白質分子內相同電荷間的靜電斥力會導致蛋白質伸展。從而使埋藏在蛋白質內部非電離殘基發生電離,導致失活。pH的變化可以引起蛋白質的伸展,這個過程原則上是可逆的,但這些變化常能導致不可逆的聚合或酶的自溶,引起不可逆失活。
4 氧化作用
各種氧化劑能氧化帶芳香族側鏈的氨基酸以及蛋氨酸、半胱氨酸和胱氨酸殘基,從而使蛋白質變性。分子氧,H2O2和氧自由基是常見的蛋白質氧化劑。
5 表面活性劑和去污劑
表面活性劑在很低濃度下能使蛋白質發生強烈地相互作用,導致蛋白質不可逆變性。其中陰離子去污劑的作用比陽離子和非離子去污劑強烈。
6 變性劑
6.1脲和鹽酸胍:機制尚不明確,可能是消除了維持三級結構的疏水作用力或直接與蛋白質分子作用
6.2高濃度鹽:高濃度鹽既有穩定作用也有變性作用,這要看鹽的性質和濃度。
6.3螯合:常常不可逆地失活需要金屬輔因子的酶,但可穩定不需要金屬輔因子的酶。
6.4有機溶劑改變溶液的介電常數;增加疏水核的溶解度,降低帶電表面的溶解度;奪去酶分子表面的必須水而使酶失活。
7 重金屬離子和疏基試劑
與蛋白質的疏基、二硫鍵以及色氨酸、組氨酸殘基反應。
8 熱
熱失活是溶液上最經常遇到的酶失活的原因。熱失活分兩部分:伸展---不可逆失活。
9 機械力
振動、剪切、超聲波、壓力都可能引起蛋白質的變性。這種變性理論上是可逆的,但也伴隨著其他反應而不可逆地失活。
10 冷凍和脫水
冷凍和脫水時,溶質被濃縮,引起酶微環境中pH和離子強度的劇烈改變,減弱疏水相互作用,并可能引起二硫交換和疏基的氧化。
11 輻射作用:
輻射可產生自由基(·OH,H2O2,O2-等)直接或間接地作用于蛋白質分子。
二、蛋白質失活的研究方法
案例1 組氨酸對蛋白的保護作用

Turbiscan多重光散射儀(靜態多重光散射)
用Turbiscan多重光散射儀測量高濃度蛋白溶液中的平均粒徑來監測蛋白質的聚集。該技術分析了蛋白質的自然形態與時間的關系,且無需稀釋。10 wt%濃度的牛血清白蛋白蛋白(BSA)分散于水中,在60℃下分析20h。

蛋白粒徑與組氨酸含量的關系(左:粒徑vs時間 右:粒徑@20hvs組氨酸濃度)
討論:增加組氨酸濃度可使蛋白直徑保持較低且更接近其原始狀態而不發生變性。多重光散射技術測量過程無需稀釋,可以在原位狀態下表征蛋白質的聚集變性過程,是比較科學的研究失穩過程的方法。
案例2 輻射對蛋白質穩定性的影響
2018年Chengliang Li等學者利用Turbscan(靜態多重光散射)研究了輻射對SP肌漿蛋白和MP肌肉蛋白的物理穩定性的影響。不同輻照劑量0, 3, 5 and 7 kGy的TSI不穩定性指數在3h內的變化曲線如下圖所示。
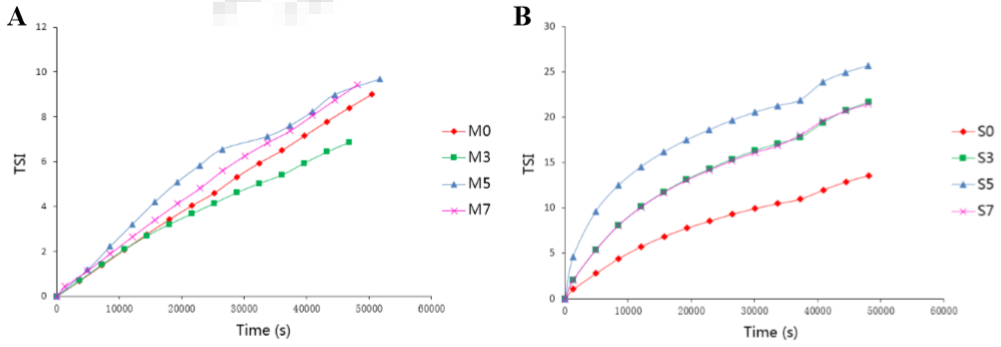
TSI穩定性指數隨時間變化關系(左:MP肌肉蛋白 右:SP肌漿蛋白)
為了表征蛋白質失穩過程的彈性和粘性性變化,Chengliang Li利用Rheolaser Master(動態多重光散射)評價了不同輻射劑量蛋白的微流變性。

Rheolaser Master光學法微流變儀
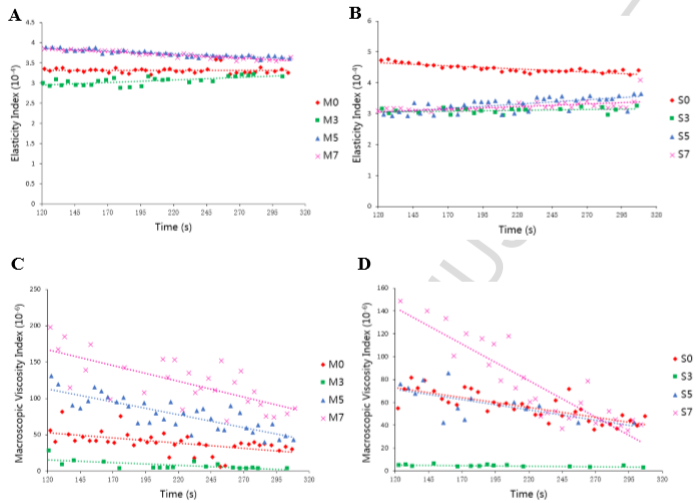
微流變性隨時間變化關系(A MP肌肉蛋白彈性 B SP肌漿蛋白彈性 C MP肌肉蛋白粘性 D SP肌漿蛋白粘性)
討論:對于MP肌肉蛋白而言,輻射劑量≥5kgy時的TSI高于輻射劑量3kgy的TSI,但是差距不大,MP的物理穩定性隨輻射劑量變化不明顯。這與微流變數據(A和C)有比較好的對應關系。另外,與SP對照組相比,輻射后的SP樣品的TSI顯著升高,說明SP可能聚集并形成蛋白質聚合物
Li C , He L , Ma S , et al. Effect of irradiation modification on conformation and gelation properties of pork myofibrillar and sarcoplasmic protein[J]. Food Hydrocolloids, 2018, 84(NOV.):181-192.
案例3 Rheolaser Crystal表征BSA蛋白的熱穩定性

Rheolaser Crystal相變分析儀
熱分析是表征蛋白熱穩定性的基本方法之一,多年以來一直廣泛應用于科研和工業中。近年來在各個領域,特別是高分子材料領域,都有了長足發展。差示掃描量熱法(DSC)是應用最廣泛的熱分析技術之一。相變分析儀(Rheolaser Crystal)與DSC應用方向類似,可以表征蛋白質的凝膠點,但是由于相變分析儀采用DWS技術,直接從顆粒的納米級運動速度獲取數據,因此對于結構變化具有更加靈敏的相應。
蛋白受熱變性性示意圖
下圖展示了用Rheolaser Crystal與DSC測量的2%BSA pH 4, 15mM NaCl水溶液的凝膠點。
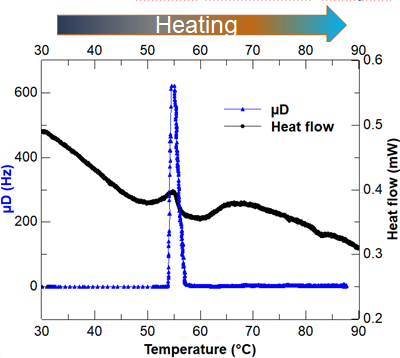
BSA蛋白的在升溫過程中的凝膠點(藍色:相變分析儀數據 黑色:DSC數據)
討論:兩個測試技術的凝膠點基本一致。DSC由于基線并不平整,熱的流量曲線在凝膠點附近出現的峰比較小,容易被忽略。而Rheolaser Crystal的峰非常清晰明了地指示了BSA的凝膠點,由于測量方法的優勢,Rheolaser Crystal不需要考慮樣品的狀態固體,粉末,液體,對樣品制樣要求不高,樣品量多少對測試結果影響不大。
結論:多重光散射技術是一種非常可靠的表征蛋白質失穩過程的儀器,采用靜態多重光散射技術的Turbiscan適合測量蛋白在原位狀態下的粒徑/微觀結構變化過程;采用動態多重光散射技術的Rheolaser Master和Rheolaser Crystal分別用于表征蛋白變質過程中的粘彈性變化過程和蛋白熱穩定性。
結晶分析儀 Rheolaser Crystal
Rheolaser Crystal用于研究樣品微觀結構的轉變過程,儀器基于先進的微流變學原理對樣品進行熱力學分析,監測所有物理現象:結晶、融化、多晶形態轉變等。Rheolaser Crystal與Rheolaser Master類似,同樣采用DWS多散斑擴散光譜學。入射的激光被樣品中的顆粒散射,產生干涉,利用高速攝像機捕捉散斑圖像。散斑圖像變換的速度直接與顆粒的運動速度相關,顆粒運動越快,散斑變化速度越快。

相關產品
更多
相關文章
更多
技術文章
2024-10-09技術文章
2024-08-10技術文章
2024-05-30技術文章
2024-05-30
虛擬號將在 秒后失效
使用微信掃碼撥號