
貝克曼庫爾特商貿(中國)有限公司
 白金會員
白金會員 已認證
已認證

貝克曼庫爾特商貿(中國)有限公司
 白金會員
白金會員 已認證
已認證
盡管不少同學與老師認為光譜流式無需像傳統流式那樣調節補償,甚至可以使用光譜接近的熒光染料,從而在流式多色方案設計上可以隨意搭配,然而,在實際嘗試光譜流式細胞儀后,這種誤解常常導致實驗結果不理想。即使在光譜流式中,熒光染料的選擇和搭配仍然需要經過精心設計和優化,以避免信號干擾和數據解讀錯誤。因此,合理設計多色實驗仍然是獲得準確可靠結果的關鍵所在。
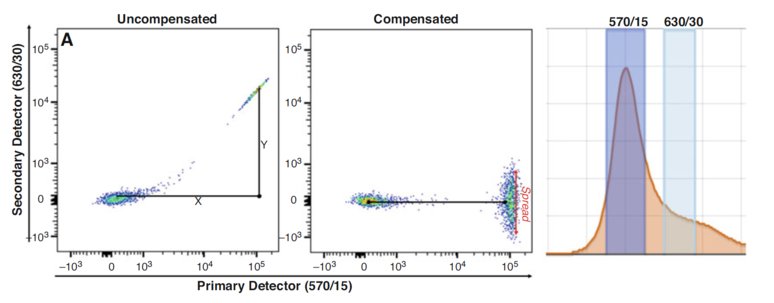
圖1:補償的定義:(a) 顯示了使用PE標記抗體染色的人外周血單個核細胞(PBMCs)未經補償(左圖)和補償后(右圖)的數據。為了去除630/30濾光片中的PE信號,需要計算Y/X*100的比例。補償后的數據展示了PE信號的擴散(spread)。(b) PE的發射譜圖中展示了在(a)圖中使用的兩個濾光片。
無論采用哪種技術,免疫分型實驗的成功都取決于對Spillover和Spread的正確理解和管理。這些概念對于實驗結果的精準性至關重要。無論使用傳統流式還是光譜流式,精心設計和優化熒光染料組合,合理應對這些關鍵挑戰,仍然是獲得可靠實驗數據的關鍵步驟。
首先,讓我們通過一個具體案例來深入理解Spread如何影響實驗結果的準確性。
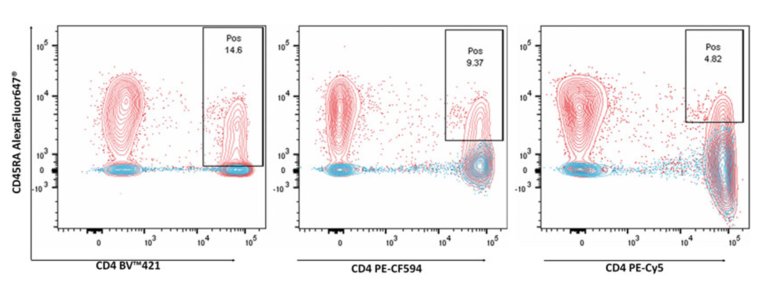
圖2:擴散(spread)現象的重要性:人類外周血單個核細胞(PBMCs)被標記了Alexa Fluor 647標記的CD45RA,以及BV421、PE-CF594或PE-Cy5標記的CD4抗體。藍色輪廓表示單色CD4染色細胞,紅色輪廓顯示了組合染色。圖中顯示雙陽性群體在低擴散(spread)情況下能更好地與單陽性群體分離,尤其是來自僅染色CD4的細胞,這通過更高百分比得以顯示。這說明擴散(spread)在數據分析中的重要性。
每種熒光染料的光譜都有可能部分重疊,即使在解混(unmix)過程中也難以完全避免這種干擾。如果不慎重選擇熒光染料組合,特別是光譜接近的染料,可能會導致解混(unmix)后信號分離不完全,進而影響實驗的準確性和可重復性。因此,無論使用的是傳統流式還是光譜流式,精心設計和優化多色免疫分型方案,合理選擇熒光染料組合,仍然是獲得可靠實驗結果的關鍵步驟。
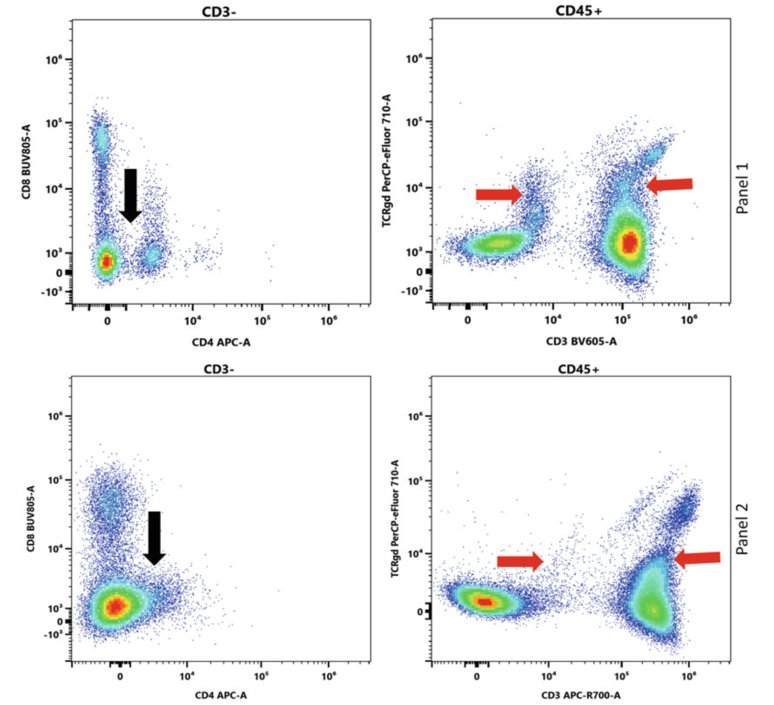
圖3:spread如何減弱信號的分離效果:在第一行(配色方案1),我們選擇了不會在APC和PerCP-eFluor 710檢測器中引起spread的熒光染料。盡管在CD4軸上有輕微但明顯的分離(黑色箭頭所示),TCRγδ單陽性和TCRγδ/CD3雙陽性信號(紅色箭頭所示)的分離效果也相對良好。在第二行(配色方案2),我們使用了BV650(結合CD45),引入了APC檢測器中的spread,并消除了配色方案1中看到的分離(黑色箭頭)。此外,將結合CD3的熒光染料從BV605改為APC-R700后,在PerCP-eFluor 710檢測器中引起了spread,導致了TCRγδ信號分離度變差(紅色箭頭)。
接下來我們進一步明確兩者的概念:
Spillover(溢出):
當熒光分子吸收光子時,會使電子躍遷至更高能級,隨后釋放出能量較低(波長較長)的光子。該光子在可見光譜范圍內。流式細胞儀不僅測量主檢測器中的熒光信號,還會在一個或多個次級檢測器中檢測到信號,這種現象被稱為“Spillover(溢出)”。
Spread(擴散):
Spillover(溢出)造成了真實信號識別的困難(光譜的重疊)。為了解決這個問題,傳統流式使用補償技術(compensation),光譜流式使用解混(unmix)技術。然而,在溢出效應時,數據的信號方差增加,會影響信號的區分和檢測靈敏度。
為了更好地評估Spillover和Spread對實驗結果的影響,我們需要使用一些專門的工具來對這兩個現象進行量化分析。這些工具能夠幫助我們深入探討不同熒光染料在檢測器中的行為,量化其對實驗數據的潛在影響。通過使用這些工具,我們不僅可以更準確地設計實驗,還能確保實驗結果的可靠性和精確性。接下來,我們將詳細介紹兩個在量化這些現象時非常有用的工具,它們將在流式細胞術實驗中發揮關鍵作用。
Spillover Spreading Matrix, SSM
(溢出擴散矩陣)
SSM 是一種定量工具,用于衡量每個熒光染料的信號在不同檢測器中的擴散(spread)。它提供了各熒光染料之間相互影響的完整矩陣信息,幫助識別可能導致數據不準確的信號重疊。
Spread Quantification Index, SQI
(擴散量化指數)
SQI 是一個獨立于熒光染料濃度和檢測器類型的標準化指數,并且通過歸一化,SQI值獨立于檢測器的電壓/增益設置,使其在不同儀器和實驗條件下具有可比性。作為評估熒光染料在多色流式細胞實驗中的spread程度的工具,有助于優化實驗設計,減少數據誤差,提高結果的可重復性和準確性。
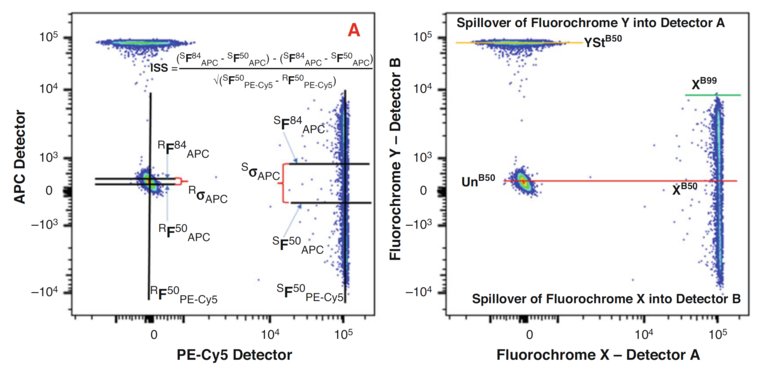
圖4:SSM(溢出擴散(spread)矩陣) 和 SQI(擴散(spread)量化指數) 的概念與計算: (a)左圖部分,首先計算Y軸上陽性和空白微球的標準差四分位數,并進行減法操作。此結果通過X軸上陽性和空白微球的中位數差進行歸一化。所得結果為Intrinsic Spillover Spread (ISS),這些數值顯示在溢出擴散(spread)矩陣中。 (b)右圖部分, 主要熒光染料X(在檢測器A)向檢測器B的溢出熒光導致了Y軸上的擴散(spread)。擴散(spread)的量化是Y軸上99百分位數和50百分位數之間的差異,并乘以歸一化因子,使得SQI值獨立于檢測器增益設置。綠色線表示99百分位數的位置。
兩個工具的的主要差異可以總結為下表:

在光譜流式的配色設計中,由于并不同于傳統流式,熒光素對應某個熒光檢測通道,每個檢測通道都會收集所有熒光染料的信號,再通過光譜解混(unmix)來分離重疊的光譜,因此需要額外的工具來優化配色方案。
Complexity Index(復雜性指數)
用于評估信號混雜和解混(unmix)的復雜程度,幫助選擇較優的熒光組合,以減少復雜性,確保多色實驗的有效性。
Similarity Matrix(相似性矩陣)
用于衡量熒光染料之間的光譜重疊程度,避免選用光譜過于接近的染料組合,從而減少解混(unmix)誤差,提高實驗精度。
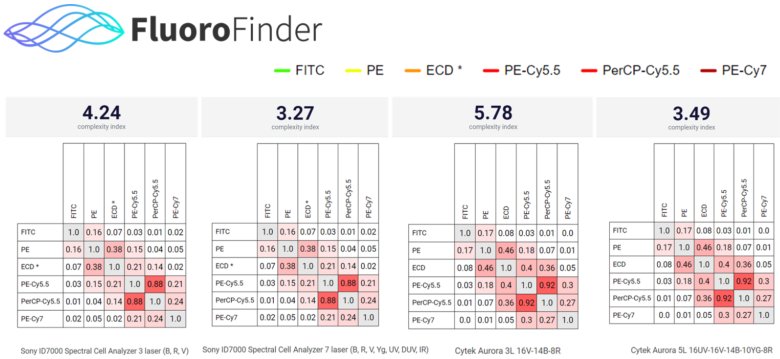
圖5:FluoroFinder 根據光譜流式細胞儀的配置和所選熒光染料生成參考Similarity Matrix(相似性矩陣) 和參考 Complexity Index(復雜性指數)。這些工具幫助用戶評估熒光染料之間的光譜重疊程度,并評估信號混雜和解混(unmix)的復雜性。通過使用這些指標,研究人員可以優化多色配色方案,選擇最佳熒光組合,減少解混(unmix)誤差,確保實驗數據的準確性和可靠性。在同型號的不同配置儀器,對于同樣的熒光素組合,其參考矩陣不同,且參考Complexity Index(復雜性指數)也不同。
通過精準掌握Spillover和Spread的概念,以及巧妙運用SSM、SQI、Complexity Index和Similarity Matrix等工具,您不僅能在傳統流式細胞術中應對復雜的多色實驗設計,還能在光譜流式中游刃有余。這樣,您的實驗數據將更加可靠和高效。
CytoFLEX 系列流式細胞儀憑借其創新的雪崩光電二極管(APD)檢測器和卓越的光學設計,實現了更低的SQI(Spread Quantification Index)。APD 檢測器具有更高的靈敏度和更低的噪聲水平,能夠更精確地捕捉微弱的熒光信號。這種設計減少了信號擴散(spread)和溢出效應,使得實驗結果更加穩定和精確。卓越的光學系統進一步優化了信號檢測路徑,確保了數據的高質量和可重復性,是多色流式細胞實驗的理想選擇。
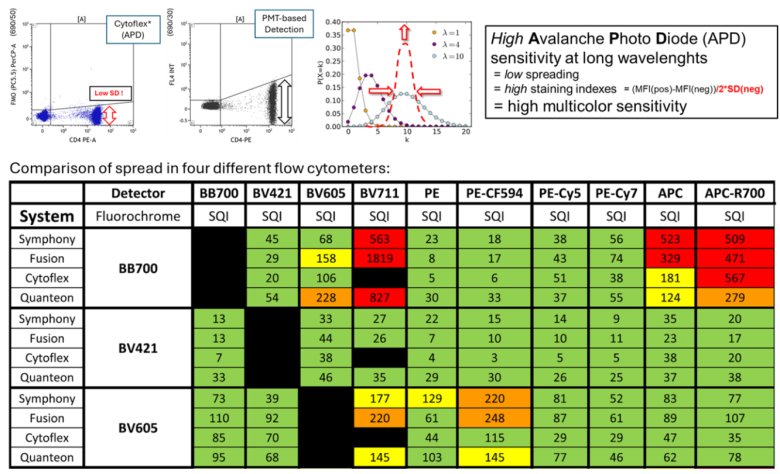
圖6:四種不同流式細胞儀中比較spread現象;使用不同的單染色微球集群在四種不同儀器上運行。對每種組合計算了SQI值。SQI值按以下范圍分類:1-120(綠色);121-199(黃色);200-299(橙色);和300以上(紅色)。
CytoFLEX流式細胞儀的補償庫設計極大地提升了多色實驗的準確性和效率。通過預先建立和存儲多種熒光染料組合的補償設置,研究人員能夠快速應用適合的補償參數,減少手動調整的時間和誤差。這不僅簡化了復雜的實驗設計過程,還確保了在多色分析中獲得一致且可靠的結果,從而使得實驗更加精確和高效。
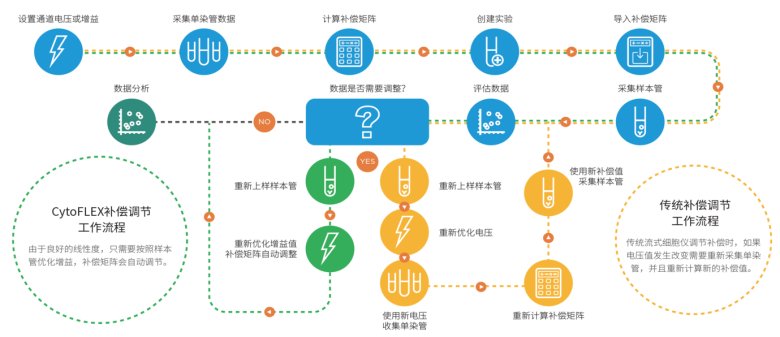
圖7:CytoFLEX流式細胞儀在多色實驗中的補償調節工作流程。CytoFLEX通過其先進的補償庫設計,使實驗過程更加高效和精準。用戶僅需設定通道電壓或增益并收集單染管數據,系統便會自動計算補償矩陣。在獲得補償庫后,若需要調整,CytoFLEX能夠智能調整增益和電壓,重新計算補償,無需重復實驗步驟。相比傳統方法,CytoFLEX的這一創新設計減少了實驗誤差,大幅提升了實驗的可重復性和效率,為研究人員提供了更強大的實驗支持。
在科學研究中,概念與方法是實驗設計的基石,而先進的技術則是實現這一切的驅動力。CytoFLEX流式細胞儀以其卓越的光學設計和智能化的補償庫,為多色實驗帶來了前所未有的精確性和效率。科技不僅是工具,更是未來的指引者,推動著我們在探索未知的道路上不斷前行。讓技術與科學相結合,共同演繹出未來的無限可能。
● 文章來源:
Bhowmick, Debajit, and Timothy P. Bushnell. "How to Measure “Spillover Spread”." *Flow Cytometry Protocols*. New York, NY: Springer US, 2024. 69-83.Ferrer-Font, Laura, et al. "Panel Design and Optimization for Full Spectrum Flow Cytometry." *Flow Cytometry Protocols*. New York, NY: Springer US, 2024. 99-124.Zargaran, Sina, et al. "Practical 10‐Color T‐Cell Panel for Phenotyping Diverse Populations Using Spectral Flow Cytometry: A Beginner's Guide." *Current Protocols* 4.3 (2024): e1020.Ferrer‐Font, Laura, et al. "Panel optimization for high‐dimensional immunophenotyping assays using full‐spectrum flow cytometry." *Current Protocols* 1.9 (2021): e222.Bhowmick, Debajit, et al. "A gain and dynamic range independent index to quantify spillover spread to aid panel design in flow cytometry." *Scientific Reports* 11.1 (2021): 20553.Park, Lily M., Joanne Lannigan, and Maria C. Jaimes. "OMIP‐069: forty‐color full spectrum flow cytometry panel for deep immunophenotyping of major cell subsets in human peripheral blood." *Cytometry Part A* 97.10 (2020): 1044-1051.Nguyen, Richard, et al. "Quantifying spillover spreading for comparing instrument performance and aiding in multicolor panel design." *Cytometry Part A* 83.3 (2013): 306-315.Roederer, Mario. "Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats." *Cytometry: The Journal of the International Society for Analytical Cytology* 45.3 (2001): 194-205.
相關產品
更多
相關文章
更多
技術文章
2024-11-21技術文章
2024-11-15技術文章
2024-11-15技術文章
2024-11-01